Beginmateriaal: RNA
Kwantitatiewe omgekeerde transkripsie-PKR (RT-qPCR) is 'n eksperimentele metode wat gebruik word in PKR-eksperimente wat RNA as die beginmateriaal gebruik.In hierdie metode word totale RNA of boodskapper-RNA (mRNA) eers in komplementêre DNA (cDNA) getranskribeer deur omgekeerde transkriptase.Vervolgens is 'n qPCR-reaksie uitgevoer met behulp van die cDNA as 'n templaat.RT-qPCR is gebruik in 'n verskeidenheid molekulêre biologie toepassings, insluitend geenuitdrukking analise, RNA interferensie validering, mikroskikking validering, patogeen opsporing, genetiese toetsing en siekte navorsing.
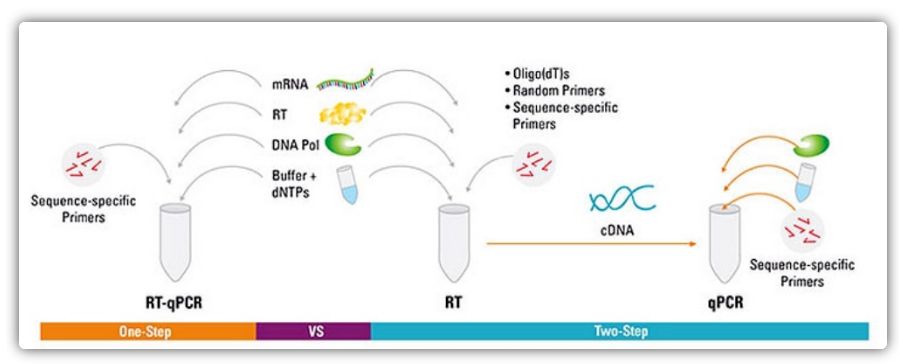
Een-stap en twee-stap metodes vir RT-qPCR
RT-qPCR kan bewerkstellig word deur 'n een-stap of twee-stap metode.Een-stap RT-qPCR kombineer omgekeerde transkripsie en PCR-amplifikasie, wat toelaat dat omgekeerde transkripsie en DNA-polimerase die reaksie in dieselfde buis onder dieselfde buffertoestande voltooi.Een-stap RT-qPCR vereis slegs die gebruik van volgorde-spesifieke primers.In twee-stap RT-qPCR word omgekeerde transkripsie en PCR amplifikasie uitgevoer in twee buise, met behulp van verskillende geoptimaliseerde buffers, reaksie toestande en primer ontwerp strategieë.
| Voordeel | Nadeel | |
| Een stap | Hierdie metode het minder eksperimentele foute aangesien beide reaksies in een buis gedoen word
Minder pipetteerstappe verminder die risiko van kontaminasie
Geskik vir hoë-deurset versterking/sifting, vinnig en reproduceerbaar | Twee-stap reaksies kan nie afsonderlik geoptimaliseer word nie
Aangesien die reaksietoestande gekompromitteer word deur die tweestapreaksie te kombineer, is die sensitiwiteit nie so goed soos dié van die tweestapmetode nie.
Die aantal teikens wat deur 'n enkele monster opgespoor word, is klein |
| Twee stappe | Vermoë om stabiele cDNA-biblioteke te skep wat vir lang tydperke gestoor kan word en in veelvuldige reaksies gebruik kan word
Teikengene en verwysingsgene kan vanaf dieselfde cDNA-biblioteek geamplifiseer word sonder die behoefte aan veelvuldige cDNA-biblioteke
Reaksiebuffers en reaksietoestande wat optimalisering van enkelreaksielopies moontlik maak
Buigsame keuse van sneller toestande | Die gebruik van veelvuldige buise en meer pipetstappe verhoog die risiko van DNA-besmetting, en tydrowend.
Vereis meer optimalisering as die eenstap-metode |
Verwante Produkte:
RT-qPCR Easyᵀᴹ (Een Stap)-SYBR Groen I
RT-qPCR Easyᵀᴹ (Een Stap)-Taqman
RT Easyᵀᴹ I Master Premix Vir Eerste-Strand CDNA Sintese
Real Time PCR Easyᵀᴹ-SYBR Green I Kit
Seleksie van totale RNA en mRNA
Wanneer 'n RT-qPCR eksperiment ontwerp word, is dit belangrik om te besluit of totale RNA of gesuiwerde mRNA as 'n sjabloon vir omgekeerde transkripsie te gebruik.Alhoewel mRNA dalk effens hoër sensitiwiteit kan verskaf, word totale RNA steeds gereeld gebruik.Die rede hiervoor is dat totale RNA 'n belangriker voordeel as uitgangsmateriaal het as mRNA.Eerstens vereis die proses minder suiweringstappe, wat beter kwantitatiewe herwinning van sjabloon en beter normalisering van resultate tot beginselgetalle verseker.Tweedens vermy dit die mRNA-verrykingstap, wat die moontlikheid van skewe resultate kan vermy as gevolg van verskillende herwinnings van verskillende mRNA's.Oor die algemeen, aangesien in die meeste toepassings die relatiewe kwantifisering van die teikengeen belangriker is as die absolute sensitiwiteit van die opsporing, is totale RNA in die meeste gevalle meer geskik.
Omgekeerde transkripsie primer
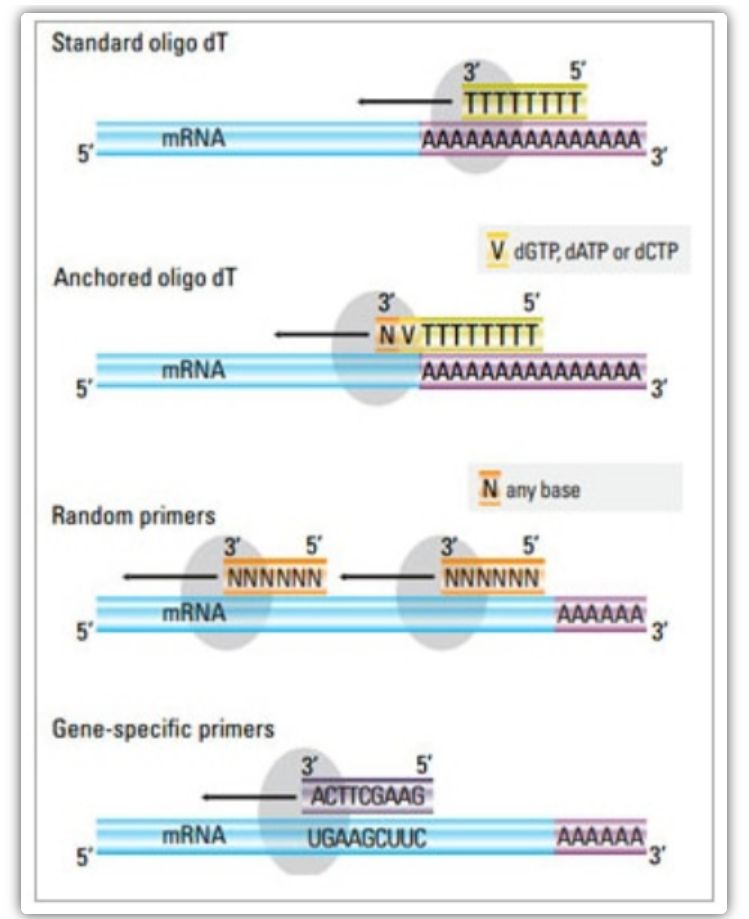
In die twee-stap metode kan drie verskillende metodes gebruik word om die cDNA reaksie te primer: oligo(dT) primers, ewekansige primers, of volgorde-spesifieke primers.Tipies word oligo(dT) primers en ewekansige primers in kombinasie gebruik.Hierdie primers gloei aan die templaat-mRNA-string en verskaf omgekeerde transkriptase met 'n beginpunt vir sintese.
| Primer seleksie | Struktuur en funksie | Voordeel | Nadeel |
| Oligo(dT) primer (of geankerde oligo(dT) primer) | Uitgebreide uitgloeiing aan timienreste by die poli(A) stert van mRNA;anker oligo(dT) primer bevat 'n G, C of A aan die 3'-punt (ankerplek) | Sintese van vollengte cDNA vanaf poli(A)-stert-mRNA
Van toepassing wanneer minder beginmateriaal beskikbaar is
Ankerplek verseker dat die oligo(dT)-primer aan die 5′-poli(A)-stert van die mRNA bind. | Slegs geskik vir die amplifisering van gene met poli(A) sterte
Verkry cDNA afgekap vanaf die priming site*2 in poli(A)
Bevooroordeeld om aan die 3′-kant te bind*
*Hierdie moontlikheid word tot die minimum beperk indien geankerde oligo(dT) primers gebruik word |
| ewekansige primer
| 6 tot 9 basisse lank, wat tydens RNA-transkripsie na verskeie plekke kan uitgloei | Uitgloei aan alle RNA's (tRNA, rRNA en mRNA)
Geskik vir transkripsies met beduidende sekondêre struktuur, of wanneer minder beginmateriaal beskikbaar is
Hoë cDNA-opbrengs | cDNA word omgekeerd getranskribeer vanaf alle RNA, wat gewoonlik nie verlang word nie en die sein van die teiken mRNA kan verdun
kry afgekapte cDNA |
| volgorde-spesifieke primers | Gepasmaakte primers wat spesifieke mRNA-volgordes teiken | spesifieke cDNA-biblioteek
Verbeter sensitiwiteit
Gebruik omgekeerde qPCR-inleiders | Slegs beperk tot die sintese van 'n enkele teikengeen |
Omgekeerde transkripsie
Omgekeerde transkriptase is 'n ensiem wat RNA gebruik om DNA te sintetiseer.Sommige omgekeerde transkriptases het RNase-aktiwiteit en kan RNA-stringe in RNA-DNA-hibriedstringe afbreek na transkripsie.As dit nie RNase ensiematiese aktiwiteit het nie, kan RNaseH bygevoeg word vir hoër qPCR doeltreffendheid.Ensieme wat algemeen gebruik word, sluit in Moloney-muizenleukemievirus-omgekeerde transkriptase en aviaire myeloblastoomvirus-omgekeerde transkriptase.Vir RT-qPCR is dit ideaal om 'n omgekeerde transkripsie met hoër termostabiliteit te kies, sodat cDNA-sintese by hoër temperature uitgevoer kan word, wat suksesvolle transkripsie van RNA's met 'n hoër sekondêre struktuur verseker, terwyl hul volle aktiwiteit regdeur die reaksie behou word, wat lei tot hoër cDNA-opbrengste.
Verwante Produkte:
Foreasy M-MLV omgekeerde transkripsie
RNase H-aktiwiteit van omgekeerde transkriptase
RNaseH is in staat om RNA-stringe van RNA-DNA-duplekse af te breek, wat doeltreffende sintese van dubbelstring-DNS moontlik maak.Wanneer lang mRNA as 'n sjabloon gebruik word, kan die RNA egter voortydig afgebreek word, wat lei tot afgekapte cDNA.Daarom is dit dikwels voordelig om RNaseH-aktiwiteit tydens cDNA-kloning te verminder indien sintese van lang transkripsies verlang word.Daarteenoor is omgekeerde transkriptases met RNase H-aktiwiteit dikwels voordelig vir qPCR-toepassings omdat dit die smelt van RNA-DNA-duplekse gedurende die eerste siklus van PCR verbeter.
Primer ontwerp
PCR-inleiders wat vir die qPCR-stap in RT-qPCR gebruik word, moet ideaal ontwerp word om 'n ekson-ekson-aansluiting te oorspan, waar 'n amplifikasie-primer moontlik oor 'n werklike ekson-intron-grens kan strek.Aangesien intron-bevattende genomiese DNA-volgordes nie geamplifiseer word nie, verminder hierdie ontwerp die risiko van vals positiewes wat geamplifiseer word van kontaminerende genomiese DNA.
As primers nie ontwerp kan word om eksons of ekson-ekson-grense te skei nie, kan dit nodig wees om RNA-monsters met RNase-vrye DNase I of dsDNase te behandel om genomiese DNA-kontaminasie te verwyder.
RT-qPCR beheer
’n Omgekeerde transkripsie-negatiewe kontrole (-RT-kontrole) moet by alle RT-qPCR-eksperimente ingesluit word om DNA-kontaminasie (soos genomiese DNA of PCR-produkte van vorige reaksies) op te spoor.Hierdie kontrole bevat alle reaksiekomponente behalwe omgekeerde transkriptase.Aangesien omgekeerde transkripsie nie met hierdie kontrole plaasvind nie, indien PCR-amplifikasie waargeneem word, is kontaminasie van DNA heel waarskynlik.
Postyd: Aug-02-2022








