Teenliggaampies, ook genoem immunoglobuliene (Ig), is glikoproteïene wat spesifiek aan antigene bind.
Konvensionele teenliggaampreparatie word geproduseer deur diere te immuniseer en antiserum te versamel.Daarom bevat antiserum gewoonlik teenliggaampies teen ander onverwante antigene en ander proteïenkomponente in die serum.Algemene antigeenmolekules bevat meestal veelvuldige verskillende epitope, so konvensionele teenliggaampies is ook 'n mengsel van teenliggaampies teen veelvuldige verskillende epitope.Selfs die konvensionele serum-teenliggaampies wat teen dieselfde epitoop gerig is, is steeds saamgestel uit heterogene teenliggaampies wat deur verskillende B-selklone geproduseer word.Daarom word konvensionele serum-teenliggaampies ook poliklonale teenliggaampies genoem, of kortweg poliklonale teenliggaampies.
Monoklonale teenliggaampies (monoklonale teenliggaampies) is 'n hoogs eenvormige teenliggaam wat deur 'n enkele B-selkloon geproduseer word en slegs teen 'n spesifieke epitoop gerig is.Dit word gewoonlik voorberei deur hibridoomtegnologie—hibridoma-teenliggaampietegnologie is gebaseer op selfusietegnologie, wat B-selle kombineer met die vermoë om spesifieke teenliggaampies en myeloomselle met oneindige groeivermoë in B-selhibridome af te skei.Hierdie hibridoomsel het die eienskappe van 'n ouersel.Dit kan onbepaald en onsterflik in vitro vermeerder soos myeloomselle, en dit kan spesifieke teenliggaampies soos milt limfosiete sintetiseer en afskei.Deur kloning kan 'n monoklonale lyn afkomstig van 'n enkele hibridoomsel, dit wil sê 'n hibridoomsellyn, verkry word.Die teenliggaampies wat dit produseer, is hoogs homogene teenliggaampies teen dieselfde antigeniese determinant, dit wil sê monoklonale teenliggaampies.
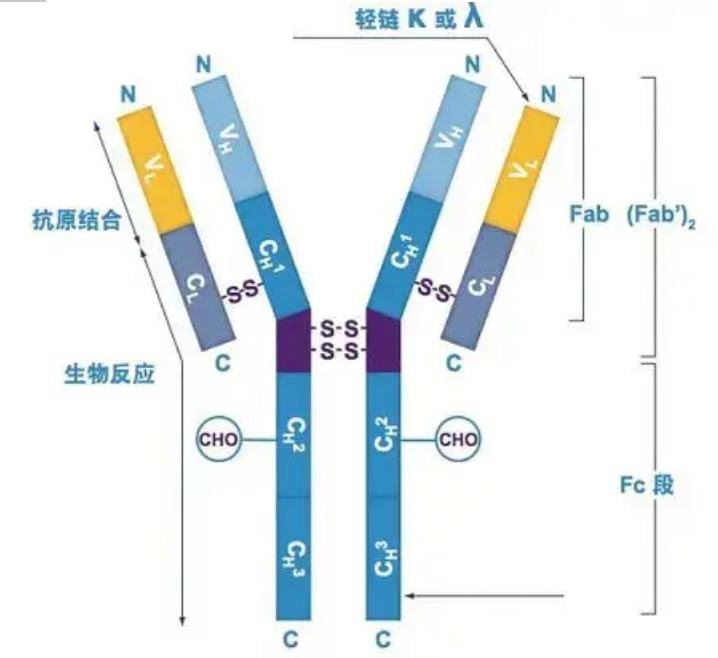
Teenliggaampies bestaan as een of meer Y-vormige monomere (dws monoklonale teenliggaampies of poliklonale teenliggaampies).Elke Y-vormige monomeer bestaan uit 4 polipeptiedkettings, insluitend twee identiese swaar kettings en twee identiese ligte kettings.Ligte ketting en swaar ketting word benoem volgens hul molekulêre gewig.Die bokant van die Y-vormige struktuur is die veranderlike gebied, wat die antigeenbindingsplek is.(Uittreksel uit Detai Bio-Monoclonal Antibody Concept)
Teenliggaam struktuur
 Swaar ketting
Swaar ketting
Daar is vyf tipes soogdier Ig swaar kettings, genoem met die Griekse letters α, δ, ε, γ en μ.Die ooreenstemmende teenliggaampies word IgA, IgD, IgE, IgG en IgM genoem.Verskillende swaar kettings verskil in grootte en samestelling.α en γ bevat ongeveer 450 aminosure, terwyl μ en ε ongeveer 550 aminosure bevat.
Elke swaar ketting het twee streke: die konstante gebied en die veranderlike gebied.Alle teenliggaampies van dieselfde tipe het dieselfde konstante gebied, maar daar is verskille tussen teenliggaampies van verskillende tipes.Die konstante streke van die swaar kettings γ, α en δ is saamgestel uit drie Ig-domeine in tandem, met 'n skarniergebied om die buigsaamheid daarvan te verhoog;die konstante streke van die swaar kettings μ en ε is saamgestel uit 4 Ig-domeine.Die veranderlike gebied van die swaar ketting van die teenliggaam wat deur verskillende B-selle geproduseer word, is anders, maar die veranderlike gebied van die teenliggaam wat deur dieselfde B-sel of selkloon geproduseer word, is dieselfde, en die veranderlike gebied van elke swaarketting is ongeveer 110 aminosure lank., En vorm 'n enkele Ig-domein.
Ligte ketting
Daar is net twee tipes ligte kettings by soogdiere: lambda-tipe en kappa-tipe.Elke ligte ketting het twee gekoppelde domeine: 'n konstante gebied en 'n veranderlike gebied.Die lengte van die ligte ketting is ongeveer 211~217 aminosure.Die twee ligte kettings in elke teenliggaam is altyd dieselfde.Vir soogdiere het die ligte ketting in elke teenliggaam net een tipe: kappa of lambda.By sommige laer gewerwelde diere, soos kraakbeenvisse (kraakbeenvisse) en beenvisse, word ander soorte ligte kettings soos die iota (iota) tipe ook aangetref.
Fab en Fc segmente
Die Fc-segment kan direk met ensieme of fluoresserende kleurstowwe gekombineer word om teenliggaampies te merk.Dit is die deel waar die teenliggaam op die plaat klink tydens die ELISA-proses, en dit is ook die deel waar die tweede teenliggaam herken en gebind word in immunopresipitasie, immunoblotting en immunohistochemie.Teenliggaampies kan in twee F(ab)-segmente en een Fc-segment deur proteolitiese ensieme soos papaïen gehidroliseer word, of hulle kan deur pepsien uit die skarniergebied gebreek word en in een F(ab)2-segment en een Fc-segment gehidroliseer word.IgG-teenliggaampies is soms baie nuttig.As gevolg van die gebrek aan die Fc-segment, sal die F(ab)-segment nie saam met die antigeen presipiteer nie, en dit sal ook nie deur immuunselle in in vivo studies gevang word nie.As gevolg van die klein molekulêre fragmente en gebrek aan kruisbindingsfunksie (as gevolg van die gebrek aan Fc-segment), word die Fab-segment gewoonlik gebruik vir radio-etikettering in funksionele studies, en die Fc-segment word hoofsaaklik gebruik as 'n blokkeermiddel in histochemiese kleuring.
Veranderlike en konstante streke
Die veranderlike streek (V-streek) is geleë by 1/5 of 1/4 (wat ongeveer 118 aminosuurreste bevat) van die H-ketting naby die N-terminus en 1/2 (wat ongeveer 108-111 aminosuurresidu bevat) naby die N-terminus van die L-ketting.Elke V-streek het 'n peptiedring wat deur binnekettingdisulfiedbindings gevorm word, en elke peptiedring bevat ongeveer 67 tot 75 aminosuurreste.Die samestelling en rangskikking van aminosure in die V-streek bepaal die antigeenbindingspesifisiteit van die teenliggaam.As gevolg van die voortdurend veranderende tipes en volgorde van aminosure in die V-streek, kan baie soorte teenliggaampies met verskillende bindende antigeenspesifisiteite gevorm word.Die V-streke van die L-ketting en H-ketting word onderskeidelik VL en VH genoem.In VL en VH het die aminosuursamestelling en volgorde van sommige plaaslike streke 'n hoër mate van variasie.Hierdie streke word hiperveranderlike streke (HVR) genoem.Die aminosuursamestelling en rangskikking van die nie-HVR-dele in die V-streek is relatief konserwatief, wat die raamwerkgebied genoem word.Daar is drie hiperveranderlike streke in VL, gewoonlik geleë by aminosuurresidu 24 tot 34 en 89 tot 97 onderskeidelik.Die drie HVR's van VL en VH word onderskeidelik HVR1, HVR2 en HVR3 genoem.Die navorsing en ontleding van X-straal kristal diffraksie het bewys dat die hiperveranderlike streek inderdaad die plek is waar die teenliggaam antigeen bind, dus word dit die komplementariteitbepalende streek (CDR) genoem.Die HVR1, HVR2 en HVR3 van VL en VH kan onderskeidelik CDR1, CDR2 en CDR3 genoem word.Oor die algemeen het CDR3 'n hoër mate van hiperveranderlikheid.Die hiperveranderlike gebied is ook die hoofligging waar die idiotipiese determinante van Ig-molekules bestaan.In die meeste gevalle speel die H-ketting 'n belangriker rol in binding aan die antigeen.
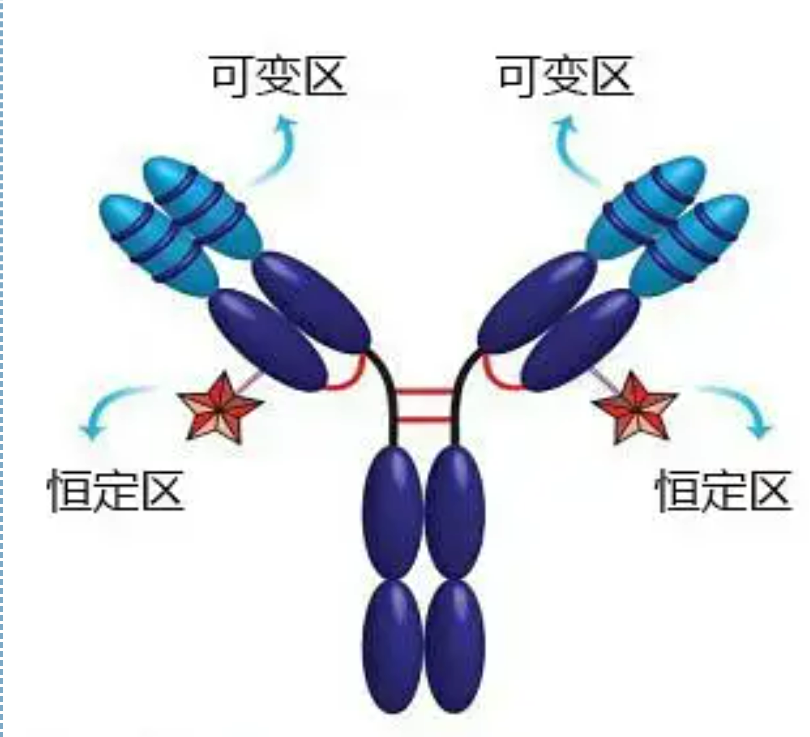 Die konstante gebied (C-streek)is geleë op 3/4 of 4/5 (ongeveer vanaf aminosuur 119 tot by die C-terminus) van die H-ketting naby die C-terminus en 1/2 (bevat ongeveer 105 aminosuurreste) naby die C-terminus van die L-ketting.Elke funksionele gebied van die H-ketting bevat ongeveer 110 aminosuurreste, en bevat 'n peptiedring wat bestaan uit 50-60 aminosuurreste wat deur disulfiedbindings verbind is.Die aminosuursamestelling en rangskikking van hierdie streek is relatief konstant in dieselfde dierlike Ig-isotipe L-ketting en dieselfde tipe H-ketting.Dieselfde, dit kan net spesifiek aan die ooreenstemmende antigeen bind, maar die struktuur van sy C-streek is dieselfde, dit wil sê, dit het dieselfde antigenisiteit.Die perd anti-mens IgG sekondêre teenliggaam (of anti-teenliggaam) kan gekombineer word met die twee 'n Kombinasie van teenliggaampies (IgG) teen verskillende eksotoksiene kom voor.Dit is 'n belangrike basis vir die voorbereiding van sekondêre teenliggaampies en die toepassing van fluoresseïen, isotope, ensieme en ander gemerkte teenliggaampies.
Die konstante gebied (C-streek)is geleë op 3/4 of 4/5 (ongeveer vanaf aminosuur 119 tot by die C-terminus) van die H-ketting naby die C-terminus en 1/2 (bevat ongeveer 105 aminosuurreste) naby die C-terminus van die L-ketting.Elke funksionele gebied van die H-ketting bevat ongeveer 110 aminosuurreste, en bevat 'n peptiedring wat bestaan uit 50-60 aminosuurreste wat deur disulfiedbindings verbind is.Die aminosuursamestelling en rangskikking van hierdie streek is relatief konstant in dieselfde dierlike Ig-isotipe L-ketting en dieselfde tipe H-ketting.Dieselfde, dit kan net spesifiek aan die ooreenstemmende antigeen bind, maar die struktuur van sy C-streek is dieselfde, dit wil sê, dit het dieselfde antigenisiteit.Die perd anti-mens IgG sekondêre teenliggaam (of anti-teenliggaam) kan gekombineer word met die twee 'n Kombinasie van teenliggaampies (IgG) teen verskillende eksotoksiene kom voor.Dit is 'n belangrike basis vir die voorbereiding van sekondêre teenliggaampies en die toepassing van fluoresseïen, isotope, ensieme en ander gemerkte teenliggaampies.
Verwante Produkte:
Cell Direct RT-qPCR-stel
Postyd: 30-Sep-2021








